연구자
-
윤정교, 이학박사
교수
Stem cell biology, Signaling pathways, Tissue regeneration, Skeletal muscle, Lung
순천향의생명연구원 본관동 206호
041-413-5016
jkyoon@sch.ac.kr
본 연구실의 장기적인 연구 관심분야는 생체기관조직의 항상성과 재생을 조절하는 분자 메커니즘입니다. 이런 연구 주제를 탐구하기 위해 세포 배양과 마우스 생체모델들을 활용하여 “골격근” 과 “폐” 라는 두 가지 특정 조직을 연구하고 있습니다.
골격근
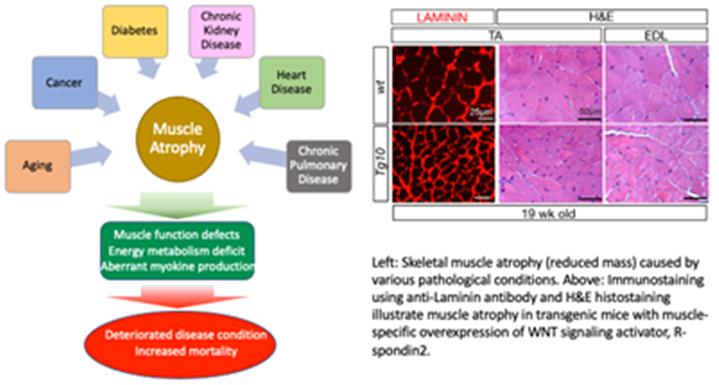
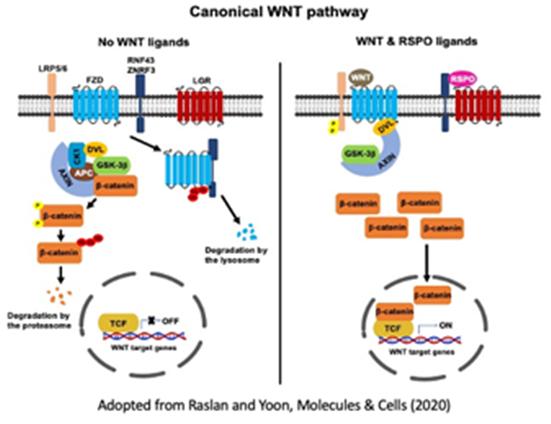
골격근은 신체 운동과 에너지 대사의 주요 기능을 담당하며 신체적 손상, 운동, 영양, 노화 및 질병 상태와 같은 다양한 생리적 변화에 대응하는 매우 역동적인 조직기관입니다. 근육 손상 또는 운동 후 근육재생 과정 시, 골격근 내에 존재하는 근육 줄기세포 (위성 세포라고도 함)는 손상된 근육을 복구하거나 근육량을 늘리기 위해 새로운 근섬유를 생성합니다. 이 외에도 줄기세포 활동과는 별개로 근섬유세포의 근육 질량조절 기능은 골격근의 항상성을 유지하는데 필요한 또 다른 핵심 세포반응으로 세포 내 단백질과 세포 내 소기관의 합성/분해 대사 간의 균형이 중요합니다. 본 실험실에서는 (1) 근육줄기세포의 증식과 정지 및 근육 분화결정과정의 분자 메커니즘과 (2) 골격 근육 질량을 제어하는 새로운 신호 경로를 조사하고 있습니다.
폐
폐는 혈액과 외부 대기 사이의 가스 교환에 중요한 기능을 담당합니다. 또한 외부 병원체 및 환경 요인에 대한 면역 방어에도 중요한 역할을 합니다. 폐는 항상성 회전율이 거의 없는 상대적으로 정지된 기관으로 분류되지만, 손상에 반응하여 폐 내에 존재하는 줄기/전구 세포에 의해 조절되는 강력한 조직 재생 능력을 갖고 있습니다. 폐 재생과정에는 기관, 기관지, 미세기관지 및 폐포와 같이 조직학적으로 구별되는 네 가지 부위내에 특이적으로 존재하는 여러 다른 유형의 줄기/전구 세포들이 조직부위별로 특정 기능을 지니게 분화된 상피 세포들을 생성합니다. WNT 신호 전달은 배아 및 태아 폐에서의 발달 역할에 중요하다고 알려져 있으며 본 실험실에서는WNT 신호전달계의 폐 재생시 어떻게 다양한 유형의 줄기/전구 세포의 기능을 조절하는 지 연구하고 있습니다.
|
Principal Investigator Biography B.S. in Zoology, Seoul National University, Korea M.S. in Zoology, Seoul National University, Korea Ph.D. in Mammalian Genetics, University of Illinois at Chicago, USA Research Fellow/ Senior Research Fellow, California Insititue of Technology, USA Faculty Scientist I/II, Maine Medical Center Research Institute, USA Associate Professor, Tufts University School of Medicine, USA Professor, Soonchunhyang Institute of Medi-bio Science(SIMS), Soonchunhyang University, Korea Research Interest - Signaling pathways in skeletal muscle regeneration and stem cells - Crosstalk between stem cells and other resident cells in skeletal muscle - Positive and negative regulators of skeletal muscle mass and their acting mechanisms - Regulation of stem cell function in lung regeneration Research Associates
Hyoshin Lee Bachelor of Science in Life Science and Biomedical Science, Hallym University, Republic of Korea Master of Science, Department of Integrated Biomedical Science, Soonchunhyang University. Republic of Korea Graduate students Jennifer Fransisca Bachelor of Science, Atma Jaya Catholic University, Indonesia Her research interest is to investigate about skeletal muscle niche components, particularly a group of mesenchymal progenitor cells called Fibro Adipogenic Progenitors (FAPs) that exhibit major impact in supporting muscle regeneration while become the main source of adipocyte and fibroblast infiltration in pathological muscle conditions. Bagus Sarmito Bachelor of Science, Atma Jaya Catholic University, Indonesia He is primarily interested in understanding the molecular mechanism by which skeletal muscle mass is regulated. Currently, he is studying a previously unknown role of chemokine CXCL14 in the regulation of skeletal muscle mass.
Youn Jeong Oh Bachelor of Science in Life Science, Hoseo University, Republic of Korea Master of Science in Biochemistry, Hoseo University, Republic of Korea Alumni Trinh Thi Tuyet Tran PhD Candidate, Nanyang Technological University, Singapore Nguyen Thi Thu Hao Postdoctoral Fellow, University of Texas Health Science Center at Houston, USA Hyunji Tak Research Associate, DT & CRO, Rebuplic of Korea Yeeun Kim Research Associate, DT & CRO, Rebuplic of Korea Ahmed Raslan Assistant Professor, Department of Zoology, Assiut University, Egypt Jay Prakash Shah Postdoctoral Fellow, University of Alabama at Birmingham, USA |




